Услуги
НАШ СЕРВИС

Слишком сложно? Тогда запросите консультацию специалиста!
Наша компания занимается тем, что помогает студентам выполнять различные учебные работы на заказ. Вы можете ознакомиться с перечнем выполняемых работ, а так же с их стоимостью на странице с ценами.
Строение электронных оболочек атомов элементов первых четырех периодов. Понятие об электронном облаке, s- и p-электронах. Радиусы атомов, их периодические изменения в системе химических элементов
Поведение электрона в атоме
Современная теория строения атома основана на законах, описывающих поведение микрообъектов – микрочастиц (элементарных частиц) Представление о поведении электронов в атоме основано на следующих положениях.
1. Квантовый характер энергетических изменений.В системе микрообъектов энергия поглощается и испускается не непрерывно, а дискретно, отдельными порциями – квантами, поэтому энергия системы микрообъектов может принимать только определенные значения, кратные числу квантов, и может изменяться скачкообразно.
Изложенные выше свойства атомов – дискретность значений их внутренней энергии и поглощение и испускание ими энергии квантами были сформулированы датским физиком Нильсом Хендриком Давидом Бором в 1913 г. в виде постулатов:
1). Атомы могут существовать, не изменяя своей энергии, т.е. не излучая и не поглощая ее, только в определенных состояниях, которые образуют дискретный ряд значений энергии, причем атом, испуская или поглощая энергию, скачкообразно переходит из одного энергетического состояния в другое.
2). При переходе из одного состояния в другое атом испускает или поглощает только энергию, пропорциональную энергии кванта DЕ = hn (h = 6,626176×10–34 Дж×с – постоянная Планка).
Поглощение или испускание атомом энергии может быть связано только с изменением энергетического состояния электрона. Следовательно, в атоме должны существовать уровни энергии (энергетические уровни), на которых находится электрон, и он может занимать только эти уровни, а не промежуточные. Должен быть один и только один энергетический уровень с минимальной энергией (основное состояние), при переходе с которого на вышестоящие уровни (возбужденное состояние) энергия поглощается, а при обратном переходе – испускается.
Таким образом, исходя из квантового характера энергетических изменений, электроны в атоме располагаются на определенных энергетических уровнях. Совокупность электронов на данном энергетическом уровне называется электронным слоем.
2. Корпускулярно-волновое поведение микрочастиц. В 1924 г. Луи де Бройль (Франция) предположил, что корпускулярно-волновой дуализм присущ не только фотонам, но и любым другим частицам. Волновые свойства частицы массой m, движущейся со скоростью v, описываются длиной волны де Бройля: 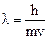 .
.
Гипотезу де Бройля подтвердили опыты по дифракции электронов, использующейся в электронографии – методе исследования структуры веществ.
3. Неопределенность положения и скорости.В 1927 г. В. Гейзенберг (Германия) сформулировал один из основных принципов квантовой механики – принцип неопределенности: невозможно одновременно определить точно и положение, и импульс (mv) микрочастицы.
Отсюда следует, что можно рассматривать лишь вероятность того, что частица находится в данном месте атомного пространства.
Исходя из двух последних представлений, для описания состояния электрона в атоме предложена вероятностная модель электронного облака, причем область атомного пространства, в которой вероятность нахождения электрона максимальна, называется атомной орбиталью (АО).
Таким образом, электроны в атомах располагаются на определенных энергетических уровнях электронными слоями. Атомные орбитали одного энергетического уровня (кроме первого) различаются по форме, поэтому электроны внутри данного электронного слоя располагаются на различных энергетических подуровнях. Совокупность электронов на данном энергетическом подуровне называется электронной оболочкой. Различают:
1) s-подуровни, форма АО на них – сферическая, на любом s-подуровне 1 АО;
2) р-подуровни, форма АО – в виде объемной восьмерки, на любом р-подуровне 3 АО;
3) d-подуровни, на любом d-подуровне 5 АО;
4) f-подуровни, на любом f-подуровне 7 АО.
Принципы заполнения АО электронами
Принцип наименьшей энергии. Сначала заполняются орбитали с самой низкой энергией.
Принцип Вольфганга Паули (Швейцария, 1925 г.). Любая элементарная частица обладает спином. Спин s (от англ. spin – кружение, верчение) определяет собственный момент количества движения элементарной частицы, не связанного с ее перемещением как целого. Спин фотона равен 1; спины электрона, нейтрона и протона – ½ (–½ и +½).
Частицы с равными полуцелыми спинами не могут находиться в одинаковом энергетическом состоянии, поэтому в одной атомной орбитали может быть максимально только 2 электрона. Этот принцип позволяет определить максимальную емкость АО, энергетических подуровней и уровней:
| Энергетический уровень | Энергетический подуровень | Число АО | Максимальное число электронов | ||
| в подуровне | в уровне | на подуровне | на уровне | ||
| s | |||||
| s | |||||
| p | |||||
| s | |||||
| p | |||||
| d | |||||
| s | |||||
| p | |||||
| d | |||||
| f |
Правило Всеволода Маврикиевича Клечковского (Россия, 1951 г.). На электрон в многоэлектронном атоме действуют наряду с силой притяжения ядра и силы отталкивания других электронов. Особенно сильным отталкивающим действием обладает 8-электронная оболочка с очень высокой электронной плотностью. Это приводит к тому, что на внешнем энергетическом уровне у нейтральных атомов не может быть больше восьми электронов. При добавлении электрона в таком случае он занимает орбиталь более высокого уровня. Так, при переходе от аргона к калию очередной электрон поступает не на 3d-подуровень, а на 4s, т. к. сила отталкивания электронов превышает силу притяжения ядра. При переходе же от кальция к скандию преобладает притяжение ядра и очередной электрон поступает на 3d-подуровень.
Исходя из вышеизложенного, порядок заполнения электронами энергетических подуровней следующий:
1s–2s–2p–3s–3p–4s–3d–4p–5s–4d–5p–6s–4f–5d–6p–7s–5f–6d–7p.
В зависимости от того, какой подуровень заполняется электронами, все химические элементы делят на 4 группы:
– s-элементы (заполняется s-подуровень внешнего электронного слоя, это элементы главных подгрупп I и II групп и Не);
– p-элементы (заполняется p-подуровень внешнего электронного слоя, это элементы главных подгрупп III–VIII групп, кроме Не);
– d-элементами (происходит заполнение d-подуровня предвнешнего электронного слоя, это элементы побочных подгрупп);
– f-элементы (заполняется f-подуровень второго от внешнего слоя, это лантаноиды и актиноиды).
Правило Фридриха Хунда (Германия, 1927 г.). Если орбитали имеют равную энергию (орбитали одного энергетического подуровня), то заполняется максимальное их число в силу отталкивания одноименно заряженных электронов. Другими словами, в пределах одного энергетического подуровня электроны заполняют АО сначала по одному, а затем спариваются.
Энергетические подуровни обладают повышенной устойчивостью, когда они не заполнены электронами, заполнены наполовину и заполнены полностью. Этим объясняется «проскок электрона» в атомах хрома, меди и др. с внешнего электронного слоя на предвнешний.
Зная последовательность заполнения АО электронами, можно составлять электронные формулы атомов элементов.
Алгоритм составления электронной формулы элемента
1. Определите номер внешнего электронного слоя в атоме n (он равен номеру периода, в котором находится символ элемента).
2. Определите, какой подуровень заполняется последним (у элементов главных подгрупп I и II групп и Не – ns; у элементов главных подгрупп III–VIII групп, кроме гелия – np; у элементов побочных подгрупп – (n–1)d; у лантаноидов и актиноидов – (n–2)f).
3. Используя порядок заполнения энергетических подуровней (см. выше), начните составлять электронную формулу, пропустив тот подуровень, который заполняется последним.
4. Определите число электронов, находящихся на подуровне, заполняющемся последним. Для s-элементов оно совпадает с номером группы; для р-элементов оно равно разности (номер группы – 2); для d- и f-элементов оно определяется тем, каким по счету является элемент в d- или f-семействе данного периода. Не забывайте про «проскок» электрона у атомов некоторых элементов!
1.7. Химический элемент кислород имеет электронную формулу валентных электронов:
1) 2s22p4; 2) 3s23p6; 3) 3s23p4; 4) 2s22p6.
1.8. Распределение электронов по энергетическим уровням для атома фосфора – это набор чисел: 1) 2,6,3; 2) 2,6,5; 3) 2,8,3; 4) 2,8,5.
1.9. Химический элемент расположен в 4-м периоде, IА группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2, 8, 8, 2; 2) 2, 8, 18, 1; 3) 2, 8, 8, 1; 4) 2, 8, 18, 2.
1.10. Число неспаренных электронов в атоме брома равно:
1) 1; 2) 2; 3) 5; 4) 7.
1.11. Ион, в составе которого 16 протонов и 18 электронов имеет заряд:
1) +4; 2) –2; 3) +2; 4) –4.
1.12. Какой из частиц соответствует электронная формула 1s22s22p63s23p6:
1) F–; 2) P+3; 3) Si+4; 4) S–2.
1.13. Состояние электрона в атоме характеризует:
1) энергия; 2) скорость; 3) направление движения; 4) положение в пространстве.
1.14. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса: 1) Li, Be, B, C; 2) Be, Mg, Ca, Sr; 3) N, O, F, Ne; 4) Na, Mg, Al, Si.
1.15. Способность атомов присоединять электроны увеличивается в ряду:
1) Cl, Br, F; 2) S, Se, O; 3) N, O, Si; 4) P, S, Cl.
1.16. Металлические свойства элементов в ряду Na → Mg → Al:
1) усиливаются, так как увеличивается число валентных электронов;
2) изменяются периодически, так как возрастает заряд ядра;
3) уменьшаются, так как уменьшается атомный радиус;
4) не изменяются, так как в атомах этих элементов одинаковое число электронных слоев.
1.17. Неметаллические свойства у элементов А-групп усиливаются:
1) слева направо и в группах сверху вниз; 3) справа налево и в группах снизу вверх;
2) справа налево и в группах сверху вниз; 4) слева направо и в группах снизу вверх.
1.18. У какого элемента наиболее выражены неметаллические свойства?
1) Si; 2) C; 3) Ge; 4) Sn.
Конечно, для полного рассмотрения вопроса 'Атом не может непрерывно изменять свое состояние и испускать и поглощать энергию любыми порциями, а только квантами', приведенной информации не достаточно, однако чтобы понять основы, её должно хватить. Если вы изучаете эту тему, с целью выполнения задания заданного преподавателем, вы можете обратится за консультацией в нашу компанию. В нашей команде работает большой состав специалистов, которые разбираются в изучаемом вами вопросе на экспертном уровне.
Хм, так же просматривали
Услуги
НАШ СЕРВИС