Формула Курлова, название воды. Графические изображения химического состава подземных вод.
1. Пересчет результатов химических анализов.Для выяснения количественных соотношений между ионами данные химических анализов, выполненные химической лабораторией, должны быть представлены в миллиграмм-эквивалентной форме, т.к. ионы в растворе реагируют между собой в эквивалентных количествах.
Пересчет из ионной формы, выраженной в мг/л в моль-экв, осуществляется делением числа кг каждого иона на его эквивалентный вес (ионный вес, деленный на валентность) или умножением на пересчетный коэффициент. Наиболее просто находить моль-экв.. пользуясь пересчетной таблицей.
Например:

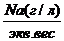 =Na моль-экв. или
=Na моль-экв. или
Na(мг/л)* К=Na моль- экв,. 
где Кпересчетный коэффициент.
2.Пересчет результатов анализов. Пересчет результатов анализов заканчивается выражением его в процентах моль-эквивалентов. Для этого принимают каждую из вычисленных сумм мг/экв. катионов и анионов за 100% и по формулам
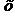 А – 100%
А – 100%
Cl – x
x = 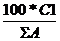 = Cl%
= Cl%
определяют процентное содержание каждого из катионов и анионов в отдельности. Все данные записывают в соответствующую ведомость химических анализов.
Ведомость химических анализов.
| Ион
| Содержание воды. 
| Общая жесткость
| Общая минерализация
|
| мг/л
| моль-экв/л
| моль-экв%
|
| Катионы
|
|
|
|
|
|
| Сумма
|
|
|
|
|
|
| Анионы
|
|
|
|
|
|
| Сумма
|
|
|
|
|
|
1. Вычисление видов жесткости. Жесткость воды обуславливается присутствием в воде ионов кальция,железа, алюминия, марганца, бария, стронция. Для вод , используемых в хозяйственных и технических целях, жесткость воды не учитывать нельзя. Жесткая вода требует больше мыла для получения пены, в ней медленнее развариваются овощи, мясо, образуется накипь на стенках труб и паровых котлов, что уменьшает теплоотдачу и требует большего потребления тепла. Различают жесткость воды общую, временную (устранимую, карбонатную) и постоянную (неустранимую, остаточную).
Общая жесткость определяется суммарным содержанием в воде иона Ca** и Mg**, так как содержание других элементов в воде ничтожно мало. Величина карбонатной жесткости соответствует количеству иона НСО 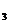 .
.
Эта величина является расчетной и определяется по количеству ионов Са** Мg**, связанных с ионами НСО 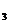 и СО
и СО 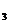 (т.е. из расчетов, выполненных в первой части задания, берут количество ионов НСО
(т.е. из расчетов, выполненных в первой части задания, берут количество ионов НСО 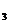 и СО
и СО 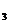 в моль-эквивалентной форме – это и есть карбонатная жесткость).
в моль-эквивалентной форме – это и есть карбонатная жесткость).
Временную жесткость определяют ионы Са** и Мg**, осаживающиеся при кипячении воды в виде карбонатов вследствие разрушения гидрокарбонат – иона.
Постоянную жесткость определяют ионы Са** и Мg**, остающиеся в воде после кипячения. Это есть разность между общей карбонатной жесткостью (в моль-экв).
Жесткость воды О.А.Алекин рекомендует следующее подразделение подземных вод по степени жесткости.
Классификация подземных вод по величине жесткости.
| Вода
| Общая жесткость
|
| моль/экв
| немецкие градусы
|
| Очень мягкая
Мягкая
Ум. жесткая
Жесткая
Очень жесткая
| до 1,5
1.3 - 3.0
3.0 – 6.0
6.0 – 9.0
более 9.0
| до 4.2
4.2 – 8.4
8.4 – 16.8
16.8 – 25.8
более 25.2
|
Для питьевых целей большей частью используются подземные воды с общей жесткостью до 7 моль-экв/л (около 20 нем. град.), но в некоторых местностях для питья потребляются и более жесткие воды.
2. Для наглядного изображения химического состава можно применять запись в виде формулы Курлова. Эта запись имеет структуру в виде дроби. В числителе в убывающем порядке (по абсолютному содержанию в % экв) записываются анионы, а в знаменателе в таком же порядке – катионы. Слева от дроби в кг/л становится газовый состав (СО  , N
, N  , О
, О  , Н
, Н  , S
, S  и др.) наличие специфических элементов (Fe, Al, Cu , As, N
и др.) наличие специфических элементов (Fe, Al, Cu , As, N 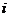 , Br, D, F и др.). Справа от дроби указывают температуру воды в
, Br, D, F и др.). Справа от дроби указывают температуру воды в 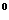 С, активную реакцию рН, расход источника или дебит скважины, м
С, активную реакцию рН, расход источника или дебит скважины, м 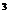 /сутки.
/сутки.
Например:
[CO 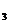 ]
]  Fe
Fe 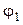 F
F 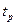 M
M 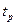
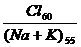
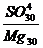
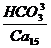 рН 6.3 Т
рН 6.3 Т  G 25 D150
G 25 D150
В наименование состава воды включаются анионы и катионы, содержание которых превышает 25%-экв, название включает и специфические элементы, а также газовый состав.
Основные ионы Курлов М.Г. предлагает назвать в убывающем порядке, причем, первыми называются анионы, а вторыми , в таком же порядке – катионы. В приведенном примере название состава воды, выраженной формулой Курлова, будет борная, углекислая, железистая, фтористая, хлоридно- сульфатная натриево-магниевое.
Как видно из указанного примера, основные ионы определяют химический состав воды, а газовый и специфические элементы – специфическое содержание. При составлении химического названия воды необходимо соблюдать элементарные правила русского языка, согласно которым основное прилагательное пишется полностью а прилагательное, указывающее на второстепенное свойство предмета, пишется сокращенно. Если в химическом составеводы преобладают анионы хлоридный и сульфатный, причемсульфатного больше, чем хлоридного, то воду следует называть хлоридно-сульфатной, а не сульфатно-хлоридной.
Приведем два примера. Химический состав вод изображен в виде формул Курлова, причем скобками второстепенные ионы отделены от главных.
Первый пример:
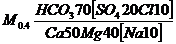
Здесь мы имеем пресную, гидрокарбонатную магниево-кальциевую воду с повышенным содержанием сульфатов. По классификации О. А. Алекина, данная вода принадлежит к гидрокарбонатному классу, группе кальция и магния и второму типу (CIICa, Mg0.4).
Второй пример:
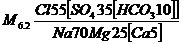
Вода солоноватая, сульфатно-хлоридная магниево-натриевая.
Как установлено, ионная форма свойственна в полной мере лишь водам низкой минерализации. При увеличении концентрации растворенных солей между ионами усиливается взаимодействие, причем развивается процесс, обратный диссоциации, т. е. ассоциация. В растворе образуются ассоциированные пары: нейтральные ( СаSО40, МgSО40, СаСО30) или несущие заряд (Mg(HCO3)2 Са(НСО3)2+).Ввиду сложности химического состава природных растворов во многих случаях нельзя предугадать, какие соли в каком порядке будут выпадать из данного раствора, так как на ход кристаллизации влияет температура и другие факторы. Поэтому наши пересчеты из ионной в солевую форму принято называть гипотетическими. При оценке питьевых, лечебных, технических и других качеств воды полезно принимать во внимание не только абсолютное содержание отдельных ионов, но
и предполагаемые ассоциации анионов с катионами (соли). Изображение химического состава вод в виде солей следует рассматривать как очень удобную рабочую гипотезу, позволяющую лучше разобраться в химических свойствах и происхождении природных вод.Пересчет из ионной формы в солевую производится в соответствии с растворимостью солей. В первую очередь комбинируются малорастворимые, а затем все более и более растворимые.
Простейшим для изображения единичных анализов является график-прямоугольник химического состава воды. График строится в виде двух прямоугольников, на одном из которых в масштабе нанесены %-эквиваленты анионов, на другом %-эквивалента катионов в последовательности, определяемой правилом Фрезениуса, т.е. в порядке их химической активности: К*, Na*, Mg**, Fe, Mg, H, NO , Cl, Br, I, SO, НCO, CO, OH. ????
Графически изображать единичные анализы можно также с помощью круглой диаграммой Н.И.Толстихина.
Горизонтальной линией круг делится на две части. В верхней части по секторам откладываются в масштабе катионы слева направо в обратном порядке , чем на прямоугольной диаграмме, а в нижней - в таком же порядке анионы. Диаметр круга в масштабе отвечает минерализации воды, точно также и ширина прямоугольной диаграммы в масштабе соответствует величине минерализации воды.
Классификация Алекина О.А. сочетает принцип преобладающего иона и соотношение между ионами. За основу взято шесть главных иона (3 катиона, 3 аниона), содержание которых выражено в моль- эквивалентах:
По преобладающему аниону воды подразделяются на три класса: гидрокарбонатные и карбонатные (НСО 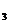 + СО
+ СО 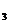 ), запись в виде символа (С); сульфатные (SO
), запись в виде символа (С); сульфатные (SO 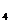 ) символическая запись (S) и хлоридные (Сl) – символическая запись такая же. По преобладающему катиону классы подразделяются на группы Са
) символическая запись (S) и хлоридные (Сl) – символическая запись такая же. По преобладающему катиону классы подразделяются на группы Са 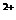 , Мg
, Мg 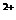 ,Na
,Na 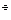 + K
+ K 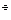 .
.
Каждая группа по соотношению между ионами подразделяются на три типа. Всего выделено четыре типа:
I) НСО 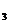 > Са+Мg. Воды маломинерализованные, характерен избыток ионов НСО
> Са+Мg. Воды маломинерализованные, характерен избыток ионов НСО 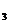 над суммой ионов щелочноземельных материалов.
над суммой ионов щелочноземельных материалов.
II) НСО 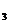 <Са+Мg<НСО
<Са+Мg<НСО 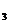 +SO
+SO 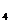 . Воды малой и средней минерализаций, большей часть
. Воды малой и средней минерализаций, большей часть
сульфатные натриевые, преобладающей солью является NaSO 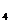 .
.
III) НСО 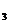 +SO
+SO 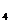 <Ca+Mg. Воды этого типа сильноминерализованные – это воды океанов,
<Ca+Mg. Воды этого типа сильноминерализованные – это воды океанов,
морей, лиманов, реликтовых водоемов, глубоко залегающих подземных вод и т.п. Этот тип воды подразделяется подразделяется на два подтипа: III 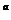 .Са
.Са 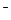 < Na
< Na 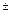 + Mg
+ Mg 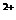 , воды хлоридные магниевые и
, воды хлоридные магниевые и
Основная итература:ОЛ 1 [38-58], 3 [27-44].
Дополнительная литература: ДЛ 1 [28-32].
Контрольные вопросы:
1. Кто разработал прямоугольный график?
2. Как рассчитывается общая жесткость?
3. Какая единица измерения минерализации?
4. В названии воды какие входят ионы ?
Конечно, для полного рассмотрения вопроса 'Лекция:АНАЛИЗ ХИМИЧЕСКИХ РЕЗУЛЬТАТОВ ПОДЗЕМНЫХ ВОД.', приведенной информации не достаточно, однако чтобы понять основы, её должно хватить. Если вы изучаете эту тему, с целью выполнения задания заданного преподавателем, вы можете обратится за консультацией в нашу компанию. В нашей команде работает большой состав специалистов, которые разбираются в изучаемом вами вопросе на экспертном уровне.



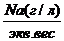 =Na моль-экв. или
=Na моль-экв. или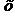 А – 100%
А – 100%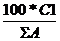 = Cl%
= Cl%
 .
.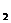 , N
, N  и др.) наличие специфических элементов (Fe, Al, Cu , As, N
и др.) наличие специфических элементов (Fe, Al, Cu , As, N 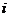 , Br, D, F и др.). Справа от дроби указывают температуру воды в
, Br, D, F и др.). Справа от дроби указывают температуру воды в 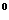 С, активную реакцию рН, расход источника или дебит скважины, м
С, активную реакцию рН, расход источника или дебит скважины, м 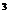 /сутки.
/сутки. Fe
Fe 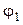 F
F 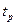 M
M 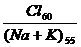
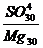
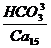 рН 6.3 Т
рН 6.3 Т  G 25 D150
G 25 D150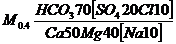
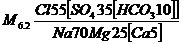
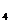 ) символическая запись (S) и хлоридные (Сl) – символическая запись такая же. По преобладающему катиону классы подразделяются на группы Са
) символическая запись (S) и хлоридные (Сl) – символическая запись такая же. По преобладающему катиону классы подразделяются на группы Са 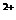 , Мg
, Мg 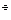 + K
+ K 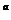 .Са
.Са 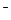 < Na
< Na 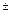 + Mg
+ Mg 




